Этилциклогексан Содержание Строение | Свойства |...
Циклоалканы
органическое веществоциклоалкановциклогексанводородаэтильнойконформацииуглеродажидкостьтемпературой кипениятемпературой плавленияплотностьюгалогенированиянитрованиясульфохлорированияокисленияспирткетондикарбоновую кислотудегидрируетсяэтилбензоланефтепродуктахгидрированием
| Этилциклогексан | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | Этилциклогексан |
| Хим. формула | C8H16 |
| Физические свойства | |
| Молярная масса | 112,21 г/моль |
| Плотность | 0,779 г/см³ |
| Термические свойства | |
| Т. плав. | -111 °C |
| Т. кип. | 129,4 °C |
| Оптические свойства | |
| Показатель преломления | 1,427 |
| Классификация | |
| Рег. номер CAS | 1678-91-7 |
| PubChem | 15504 |
| Рег. номер EINECS | 216-835-0 |
| SMILES | CCC1CCCCC1 |
| InChI | 1S/C8H16/c1-2-8-6-4-3-5-7-8/h8H,2-7H2,1H3 IIEWJVIFRVWJOD-UHFFFAOYSA-N |
| ChemSpider | 14751 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
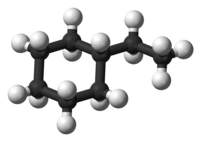
Этилциклогексан — органическое вещество класса циклоалканов с химической формулой C8H16
Содержание
1 Строение
2 Свойства
3 Получение
4 Примечания
5 Литература
Строение |
По своему строению этилциклогексан относится к моноциклическим углеводородам со средним размером цикла. Он представляет собой циклогексан, у которого один атом водорода замещен этильной группой[1].
Данное вещество существует в конформации кресла. Такая конформация наиболее симметрична и каждый атом углерода в цикле имеет по две неэквивалентные связи С—Н. Связи, которые расположены параллельно вертикальной оси симметрии третьего порядка — аксиальные, а те, что ориентированы под углом 109,5 ° относительно оси — экваториальные[2].
Свойства |
Этилциклогексан — бесцветная жидкость с температурой кипения 129,4 °С, температурой плавления -111 °С и плотностью 0,779 г/см3[3].
По химическим свойствам этилциклогексан похож на алкан. Он может вступать в реакции галогенирования, нитрования, сульфохлорирования и др. В реакции окисления вступает только в жестких условиях, образуя соответствующий циклический спирт, кетон или дикарбоновую кислоту (в случае разрыва цикла). В присутствии катализаторов дегидрируется с образованием этилбензола[4]:
- C6H11C2H5→t,p,NiC6H5C2H5+3H2{displaystyle {mathsf {C_{6}H_{11}C_{2}H_{5}{xrightarrow[{}]{t,p,Ni}}C_{6}H_{5}C_{2}H_{5}+3H_{2}}}}
Получение |
Этилциклогексан содержится в нефтепродуктах и выделяется из них в промышленном масштабе. Также возможно его получение каталитическим гидрированием этилбензола[5]:
- C6H5C2H5+3H2→t,p,NiC6H11C2H5{displaystyle {mathsf {C_{6}H_{5}C_{2}H_{5}+3H_{2}{xrightarrow[{}]{t,p,Ni}}C_{6}H_{11}C_{2}H_{5}}}}
Примечания |
↑ Белобородов В.Л., Зурабян С.Э., Лузин А.П., Тюкавкина Н.А., 2003, с. 171.
↑ Белобородов В.Л., Зурабян С.Э., Лузин А.П., Тюкавкина Н.А., 2003, с. 114—115.
↑ 1678-91-7 Ethylcyclohexane
↑ Белобородов В.Л., Зурабян С.Э., Лузин А.П., Тюкавкина Н.А., 2003, с. 178—179.
↑ Белобородов В.Л., Зурабян С.Э., Лузин А.П., Тюкавкина Н.А., 2003, с. 174—177.
Литература |
- Белобородов В.Л., Зурабян С.Э., Лузин А.П., Тюкавкина Н.А. Органическая химия / под ред. Тюкавкиной Н.А. — М.: Дрофа, 2003. — Т. 1. — 640 с. — ISBN 5-7107-7589-4.
![{displaystyle {mathsf {C_{6}H_{11}C_{2}H_{5}{xrightarrow[{}]{t,p,Ni}}C_{6}H_{5}C_{2}H_{5}+3H_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f4220cfcb89f169eca925d073d6f1b3f7280cb32)
![{displaystyle {mathsf {C_{6}H_{5}C_{2}H_{5}+3H_{2}{xrightarrow[{}]{t,p,Ni}}C_{6}H_{11}C_{2}H_{5}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5bec8c2018b3a781adc1971641098e83240e0435)