Нуклеофил Содержание Примеры | Классификация | Шкалы...
Физическая органическая химия
лат.др.-греч.химическую связьэлектрофиломэлектронную паруоснованиями ЛьюисаионыэлектрофиламиNH3H2Oзамещенияприсоединенияэлектрофилеатомное ядрооснованияpKaтиоцианат-ион SCN−галогеноалкановКристофером Ингольдомбимолекулярного нуклеофильного замещениякислородауглеродаионаэлектрофиломорбиталиэлектронысвязьэлектрофиломаммиакаминыазидыводаспиртыреакции Вильямсонаоснованиеспирткислородаэпоксидагетероцикласерытиолыэлектрофиловальфа-эффектом1953 годуSN2константа скоростиконстанта скоростиCH3BrCH3I1972 годукатионаводойпринципом взаимозависимости реакционной способности и селективности1994электрофиловконстанта скорости
Нуклеофил в химии (лат. nucleus «ядро», др.-греч. φιλέω «любить») — реагент, образующий химическую связь с партнером по реакции (электрофилом) по донорно-акцепторному механизму, предоставляя электронную пару, образующую новую связь[1]. Вследствие того, что нуклеофилы отдают электроны, они по определению являются основаниями Льюиса. В роли нуклеофилов теоретически могут выступать все ионы и нейтральные молекулы с неподеленной электронной парой.
Нуклеофил — электроноизбыточный химический реагент, способный взаимодействовать с электронодефицитными соединениями (электрофилами). Примерами нуклеофилов являются анионы (Cl−, Br−, I−) и соединения с неподелённой электронной парой (NH3, H2O).
В ходе реакций замещения или присоединения нуклеофил атакует по месту полного или частичного положительного заряда на электрофиле. Название «нуклеофил» означает «любящий ядро» и отображает эту способность (атомное ядро заряжено положительно). Относительная реакционная способность нуклеофилов называется нуклеофильность. В пределах одного ряда периодической системы более сильные основания (с бóльшим значением pKa сопряженной кислоты) являются лучшими нуклеофилами. В пределах одной группы на нуклеофильность большее влияние оказывает поляризуемость — лёгкость, с которой деформируется электронное облако атома или молекулы. К примеру, в водных растворах иодид-ион I− более нуклеофилен, чем фторид F−[2].
Амбидентные нуклеофилы имеют два и более реакционных центра. К примеру, тиоцианат-ион SCN− может атаковать электрофил либо атомом серы, либо атомом азота. Реакции галогеноалканов с SCN− часто приводят к образованию смеси RSCN (алкилтиоцианата) и RNCS (алкилизотиоцианата).
Термины «нуклеофил» и «электрофил» были введены в 1929 Кристофером Ингольдом[3], заменив предложенные ранее (в 1925) Лэпворсом «катионоид» и «анионоид»[4].
Содержание
1 Примеры
2 Классификация
2.1 По типу реагирующей орбитали
2.2 По атому, образующему связь
2.2.1 Углеродные нуклеофилы
2.2.2 Азотные нуклеофилы
2.2.3 Кислородные нуклеофилы
2.2.4 Серные нуклеофилы
3 Шкалы нуклеофильности
3.1 Уравнение Свена-Скотта
3.2 Уравнение Ричи
3.3 Уравнение Майра-Патца
3.4 Объединенное уравнение
4 См. также
5 Примечания
Примеры |
В показанном ниже примере бимолекулярного нуклеофильного замещения (SN2) атом кислорода гидроксид-иона донирует пару электронов на связывание с атомом углерода в молекуле бромэтана. Связь между атомами углерода и брома разрывается по гетеролитическому механизму: бром принимает оба электрона этой связи и уходит в виде иона Br−. В данной реакции OH− является нуклеофилом, а CH3CH2Br — электрофилом.
В данной реакции атака нуклеофила происходит со стороны, противоположной уходящей группе. Вследствие этого SN2-процессы сопровождаются обращением (инверсией) конфигурации.
Классификация |
Нуклеофилы можно классифицировать несколькими способами: по типу орбитали, с которой донируются электроны, и по природе атома, который образует связь.
По типу реагирующей орбитали |
В зависимости от природы орбитали, на которой располагались электроны, пошедшие на образование связи с электрофилом, можно выделить:
π-нуклеофилы (электроны ушли с π-орбитали):
алкены, диены, алкины;- аллилсиланы, аллилгерманы, аллилстаннаны;
- алкил- и силиленоловые эфиры;
ароматические соединения;
n-нуклеофилы (электроны находились на несвязывающей орбитали — неподелённой электронной паре):
амины;
фосфины;
фосфиты;
анионы;
σ-нуклеофилы (электроны ушли с σ-орбитали):
- доноры гидрид-иона H−.
По атому, образующему связь |
Углеродные нуклеофилы |
Нуклеофилами с реакционным центром на атоме углерода являются:
- алкил- и арилметаллогалиды (например, CH3MgBr, PhMgCl и т. д.) в реакциях Гриньяра, Реформатского, Барбье и др.
- органолитиевые реагенты (PhLi) и анионы терминальных алкинов (HC≡C−Li+);
енолы и еноляты (RCH=CH−OH и RCH=CH−O−) являются амбидентными нуклеофилами и могут реагировать как по атому углерода в α-положении, так и по атому кислорода. Обычно преобладают реакции по атому углерода (при этом енолят-ионы активнее енолов[2]). Енолы и еноляты часто применяются в реакциях конденсации, например, в альдольной реакции или конденсации Кляйзена.
- другие частицы с полным или частичным отрицательным зарядом на атоме углерода (например, −CH2−NO2).
Азотные нуклеофилы |
Примерами азотных нуклеофилов являются аммиак (NH3), органические амины (RNH2, R2NH, R3N) и азиды (R−N3).
Кислородные нуклеофилы |
Типичными кислородными нуклеофилами являются вода (H2O), гидроксид-ион (OH−), спирты (ROH) и алкоксиды (RO−). В показанной ниже разновидности реакции Вильямсона сильное основание депротонирует спирт с образованием алкоксида. Атом кислорода затем внутримолекулярно замещает уходящую группу, приводя к образованию эпоксида − трёхчленного гетероцикла с одним атомом кислорода:
Серные нуклеофилы |
Серосодержащие соединения обычно являются хорошими нуклеофилами, так как атом серы легко поляризуется, что облегчает передачу электронной пары. Типичные нуклеофилы этого класса — тиолы (RSH) и тиоляты (RS−).
Шкалы нуклеофильности |
Известно несколько способов количественного описания реакционной способности нуклеофилов. Приведенные ниже методы основаны на изучении экспериментальных данных о скорости определенных реакций с участием большого количества нуклеофилов и электрофилов. Как правило, реагенты с выраженным альфа-эффектом не включаются в эти корреляции.
Уравнение Свена-Скотта |
Уравнение Свена-Скотта было выведено в 1953 году и является первой попыткой количественно описать реакционную способность нуклеофилов в реакциях SN2[5][6]:
- lg(kk0)=S⋅n{displaystyle lg {left({frac {k}{k_{0}}}right)}=Scdot n}
В этом уравнении k — константа скорости реакции стандартного субстрата с данным нуклеофилом, k0 — константа скорости реакции субстрата со стандартным нуклеофилом (водой), S — параметр чувствительности субстрата к изменению нуклеофила (для CH3Br или CH3I S принимается равным 1), n — параметр нуклеофильности (для воды n = 0, табл. 1, 2).
Таким образом, для реакций
- CH3I + H2O → CH3OH + HI
- CH3I + Nuc−H → CH3−Nuc + HI
уравнение Свена-Скотта можно записать как
- lg(kCH3I,NucHkCH3I,H2O)=n{displaystyle lg {left({frac {k_{CH_{3}I,NucH}}{k_{CH_{3}I,H_{2}O}}}right)}=n}
| Нуклеофил | Значение n | Нуклеофил | Значение n | Нуклеофил | Значение n |
|---|---|---|---|---|---|
| SO32− | 5,16 | CN− | 5,10 | I− | 5,04 |
| SCN− | 4,77 | HO− | 4,20 | N3− | 4,00 |
| Br− | 3,89 | HCO3− | 3,80 | Cl− | 3,04 |
| CH3COO− | 2,72 | SO42− | 2,50 | F− | 2,00 |
| NO3− | 1,03 | CH3OH | 0,70 | H2O | 0,00 |
| Нуклеофил | Значение n | Нуклеофил | Значение n | Нуклеофил | Значение n |
|---|---|---|---|---|---|
| F− | 2,7 | Cl− | 4,37 | Br− | 5,79 |
| I− | 7,42 | N3− | 5,78 | NC− | 6,70 |
| CH3OH | ~0,00 | H2O | 0,00 | CH3CO2− | 4,3 |
| PhO− | 5,75 | CH3O− | 6,29 | Пиридин | 5,23 |
| Анилин | 5,70 | Триэтиламин | 6,66 | PhSH | 5,7 |
Уравнение Ричи |
Уравнение Ричи было выведено в 1972 году [9] и выражается следующим образом[10]:
lg(kk0)=N+{displaystyle lg left({frac {k}{k_{0}}}right)=N^{+}},
где k0{displaystyle k_{0}} — константа скорости реакции стандартного катиона (обычно соли диазония) с со стандартным нуклеофилом (водой) в водной среде, k{displaystyle k} — константа скорости реакции с заданным нуклеофилом, N+{displaystyle N^{+}} — параметр, зависящий от нуклеофила (табл. 3):
| Нуклеофил (растворитель) | Значение N+ | Нуклеофил (растворитель) | Значение N+ |
|---|---|---|---|
| H2O (H2O) | 0,0 | MeOH (MeOH) | 0,5 |
| CN− (H2O) | 3,8 | CN− (MeOH) | 5,9 |
| HO− (H2O) | 4,5 | MeO− (MeOH) | 7,5 |
| N3− (H2O) | 5,4 | N3− (MeOH) | 8,5 |
| PhS− (ДМСО) | 13,1 | PhS− (MeOH) | 10,7 |
Важной особенностью уравнения Ричи является отсутствие параметра чувствительности субстрата (σ в уравнении Свена-Скотта). Таким образом, принимается, что относительная реакционная способность двух нуклеофилов определяется только значением N+ и не зависит от партнера по реакции. Это находится в резком противоречии с т. н. принципом взаимозависимости реакционной способности и селективности[11]. Из-за этого уравнение Ричи иногда называется «соотношение постоянной селективности»[12]. Явная упрощенность вызвала ряд публикаций о пределах его применимости[12][13].
Уравнение Майра-Патца |
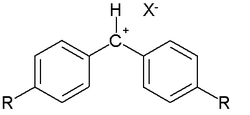
Диарилметильный катион
В 1994 г. Г. Майр и М. Патц, на основании исследования реакционной способности диарилметильных катионов и других соединений, предложили уравнение, описывающее реакционную способность достаточно большого количества нуклеофилов и электрофилов [14]:
- lg k=s(N+E){displaystyle lg k=s(N+E)}
В этом уравнении константа скорости реакции второго порядка k, измеренная при 20 °C, связывается с параметром электрофильности E (для бис(п-метоксифенил)метильного катиона E = 0), параметром нуклеофильности N и фактором чувствительности s (для реакций 2-метил-1-пентена s = 1). Для реакций незаряженных нуклеофилов константа скорости слабо зависит от растворителя и последний обычно не указывается.
Диарилметильные катионы были выбраны в качестве стандартных электрофилов потому, что их активностью можно управлять подбором заместителя R в пара-положении. Таким образом, оказалось возможным измерить реакционную способность очень разных нуклеофилов. Для протестированных соединений параметр N изменяется в диапазоне от −4,47 до 28,95 (Табл. 4)[15].

Некоторые нуклеофилы, для которых измерены параметры нуклеофильности N
| Нуклеофил | N (s) | Нуклеофил | N (s) |
|---|---|---|---|
| 1 | −4,47 (1,32) | 2 | −0,41 (1,12) |
| 3 | +0,96 (1) | 4 | −0,13 (1,21) |
| 5 | +3,61 (1,11) | 6 | +7,48 (0,89) |
| 7 | +13,36 (0,81) | PhC−(CN)CH3[16] | 28,95 (0,58) |
Параметр элекрофильности E для некоторых карбокатионов можно грубо оценить по следующему уравнению [14]:
E≈1.241lgkw−5.80{displaystyle Eapprox 1.241lg k_{w}-5.80},
где kw — константа псевдопервого порядка для реакции карбокатиона с водой при 20 °C.
Нуклеофильность N в уравнении Майра-Патца связана с параметром Ричи N+ следующим соотношением:
- N≈1.20N++6.18{displaystyle Napprox 1.20N_{+}+6.18}
Объединенное уравнение |
В попытке объединить все вышеописанные уравнения Майр с сотрудниками предложили следующее выражение[17]:
lgk=sEsN(N+E){displaystyle lg k=s_{E}s_{N}(N+E)},
где sE — параметр чувствительности электрофила; sN — параметр чувствительности электрофила; N и E имеют такое же значение, как и в уравнении Майра-Патца.
С помощью соответствующих подстановок данное выражение можно превратить в любое описанное ранее уравнение:
- при sE = 1 (для карбокатионов) это уравнение эквивалентно оригинальному уравнению Майра-Патца;
- при sN = 0.6 (для большинства n-нуклеофилов):
lgk=0.6sEN+0.6sEE{displaystyle lg k=0.6s_{E}N+0.6s_{E}E},- что эквивалентно уравнению Свена-Скотта:
lgk=lgk0+sEN{displaystyle lg k=lg k_{0}+s_{E}N};
- при sE = 1 и sN = 0.6 получим:
- lgk=0.6N+0.6E{displaystyle lg k=0.6N+0.6E}
- что эквивалентно уравнению Ричи в немного измененном виде:
- lgk−lgk0=N+{displaystyle lg k-lg k_{0}=N^{+}}
См. также |
- Реакции нуклеофильного замещения
- Реакции нуклеофильного присоединения
- Электрофил
- Основание Льюиса
Примечания |
↑ Определение, данное ИЮПАК .pdf
↑ 12 Кери Ф., Сандберг Р. Углубленный курс органической химии: Пер. с англ. = Advanced Organic Chemistry / Под ред. В. М. Потапова. — М.: Химия, 1981. — Т. 1. Структура и механизмы. — 520 с.
↑ Ingold, C. K. // Recl. Trav. Chim. Pays-Bas. — 1929.
↑ Lapworth, A. // Nature. — 1925. — Vol. 115. — P. 625.
↑ C. Gardner Swain, Carleton B. Scott. Quantitative Correlation of Relative Rates. Comparison of Hydroxide Ion with Other Nucleophilic Reagents toward Alkyl Halides, Esters, Epoxides and Acyl Halides (англ.) // J. Am. Chem. Soc.. — 1953. — Vol. 75. — P. 141-147.
↑ Swain–Scott equation (англ.). IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (7 September 2009). Проверено 22 августа 2010. Архивировано 7 мая 2012 года.
↑ Химическая энциклопедия./ Нуклеофильные реакции. // Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988 год. — Т. 3.
↑ R. G. Pearson, H. Sobel, J. Songstad. Nucleophilic reactivity constants toward methyl iodide and trans-[Pt(py)2Cl2] (англ.) // J. Am. Chem. Soc.. — 1968. — Vol. 90. — P. 319-326.
↑ 12 C. D. Ritchie. Nucleophilic reactivities toward cations (англ.) // Acc. Chem. Res. — 1972. — Vol. 5. — P. 348−354. — DOI:10.1021/ar50058a005.
↑ Ritchie equation (англ.). Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). IUPAC. doi:10.1351/goldbook.R05402. Проверено 22 августа 2010. Архивировано 7 мая 2012 года.
↑ «Чем более активен реагент, тем он менее селективен.»
↑ 12 S. Minegishi, H. Mayr. How Constant Are Ritchie's “Constant Selectivity Relationships”? A General Reactivity Scale for n-, π-, and σ-Nucleophiles (англ.) // J. Am. Chem. Soc.. — 2003. — Vol. 125. — P. 286−295. — DOI:10.1021/ja021010y.
↑ P. Denton, C. D. Johnson. Selectivity and the Ritchie equation (англ.) // J. Chem. Soc., Perkin Trans. 2. — 1995. — P. 477 - 481. — DOI:10.1039/P29950000477.
↑ 12 H. Mayr, M. Patz. Scales of Nucleophilicity and Electrophilicity: A System for Ordering Polar Organic and Organometallic Reactions (англ.) // Angew. Chem. Int. Ed. Engl. — 1994. — Vol. 33. — P. 938−957. — DOI:10.1002/anie.199409381.
↑ 12 H. Mayr et al. Mayr's Database of Reactivity Parameters (англ.). Проверено 2 сентября 2010. Архивировано 7 мая 2012 года.
↑ В ДМСО.
↑ T. B. Phan, M. Breugst, H. Mayr. Towards a General Scale of Nucleophilicity? (англ.) // Angew. Chem. Int. Ed. — 2006. — Vol. 45. — P. 3869–3874. — DOI:10.1002/anie.200600542.



















