Сложные тиоэфиры Содержание Получение | Реакции |...
АлканыАлкеныАреныАлкиныДиеныЦиклоалканыАминыОкиси аминовАмидыГидразидыНитросоединенияНитрозосоединенияОксимыНитрилыИзонитрилыАминокислотыБелкиПептидыФосфиныФосфонистые кислотыФосфиновые кислотыФосфоновые кислотыНуклеиновая кислотаНуклеотидыСиланыСилазаныСилтианыСилоксаныСиликоныГалогенуглеводородыЦиклические соединенияПерфторуглеводороды
Сложные эфирыТиосоединения
сложными эфирамитиоловкарбоновых кислотацетил-CoAдициклогексилкарбодиимидаDCCАнгидриды карбоновых кислотлактоныреакции Мицунобуспиртовкарбонилированиемалкеновалкиновнуклеофиламихлорангидридамиамидовреакция Фукуямыкетоныконденсациижирных кислотмевалонаталигниновкофейной кислотыАцетогенезацетил-CoAАТФубиквитинированииубиквитинлигазамипротеосомамитромбоцитовтиклопидинклопидогрелпрасугрелсложноэфирнойреагентом Лоуссона
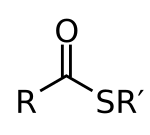
Общая структура сложных тиоэфиров
Сложные тиоэфиры — органические соединения, содержащие функциональную группу C-S-CO-C и являющиеся сложными эфирами тиолов и карбоновых кислот. Сложные тиоэфиры играют важную роль в биохимических процессах, наиболее известный представитель этого класса — ацетил-CoA.
Содержание
1 Получение
2 Реакции
3 Биохимия
4 Тионовые эфиры
5 Примечания
Получение |
Способы получения сложных тиоэфиров разнообразны,[1] но важнейшим является конденсация тиолов и карбоновых кислот в присутствии водоотнимающих реагентов[2] (например, N,N'-дициклогексилкарбодиимида[3] (DCC, ДЦК):
- RSH + R’CO2H → RSC(O)R' + H2O
Ангидриды карбоновых кислот и некоторые лактоны реагируют подобным же образом с тиолами в присутствии оснований.
Сложные тиоэфиры удобно получать по реакции Мицунобу из спиртов и тиокислот (например, тиоацетаты из тиоуксусной кислоты[4]).
Также они могут быть получены карбонилированием алкенов и алкинов в присутствии тиолов.[5]
Реакции |
Карбонильная группа сложных тиоэфиров реакционноспособна по отношению к атаке нуклеофилами (в меньшей степени по сравнению с хлорангидридами кислот). Так, сложные тиоэфиры реагирут с аминами с образованием амидов:
Уникальна для сложный тиоэфиров реакция Фукуямы: при взаимодействии с цинкорганическим соединенем в присутствии палладиевого катализатора образуются кетоны.
Атомы водорода в α-положении к карбонильной группе сложных тиоэфиров проявляют умеренную кислотность, поэтому сложные тиоэфиры подвержены альдольной конденсации. Эта реакция имеет значение для биосинтеза жирных кислот.
Биохимия |

Ацетил-CoA, ключевой интермедиат в биосинтезе различных классов органических соединений (ацетилирующий реагент).
Сложные тиоэфиры — обычные интермедиаты во многих биохимических превращения, включая образование и распад жирных кислот и мевалоната — синтетического предшественника стероидов. Биосинтез лигнинов, составляющих значительную часть биомассы, протекает через образование сложного тиоэфира кофейной кислоты.[6] Другие примеры сложных тиоэфиров — малонил-CoA, ацетоацетил-CoA, пропионил-CoA и циннамоил-CoA. Ацетогенез протекает через образование ацетил-CoA. Сложные тиоэфиры образуются в живых организмах в результате реакций эстерификации, причем АТФ играет роль дегидратирующего агента. Они также играют ключевую роль в убиквитинировании протеинов убиквитинлигазами, помечающими белки для последующего разрушения протеосомами.
Предполагается, что окисление атома серы сложных тиоэфиров (тиолактонов) является необходимым этапом активации ряда ингибиторов агрегации тромбоцитов, таких как тиклопидин, клопидогрел и прасугрел.[7][8]
Тионовые эфиры |

Метилтионобензоат
Тионовые эфиры (О-эфиры тиокарбоновых кислот) — изомеры сложных тиоэфиров. Атом серы в тионовых эфирах замещает карбонильный атом кислорода сложноэфирной группы, например: C6H5C(S)OCH3 (метилтионобензоат). Эти соединения обычно получают по реакции тиоацилхлоридов со спиртами, они также могут быть получены обработкой сложных эфиров реагентом Лоуссона.[9]
Примечания |
↑ Fujiwara, S.; Kambe, N. Thio-, Seleno-, and Telluro-Carboxylic Acid Esters // Topics in Current Chemistry. — Berlin / Heidelberg : Springer, 2005. — Vol. 251. — P. 87–140. — ISBN 978-3-540-23012-0. — DOI:10.1007/b101007.
↑ Synthesis of thioesters (неопр.). Organic Chemistry Portal. Архивировано 29 октября 2012 года.
↑ Mori, Y.; Seki, M. (2007), "Synthesis of Multifunctionalized Ketones Through the Fukuyama Coupling Reaction Catalyzed by Pearlman's Catalyst: Preparation of Ethyl 6-oxotridecanoate", Org. Synth. Т. 84: 285, <http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=V84P0285> ; Coll. Vol. Т. 11: 281
↑ Volante, R. (1981). “A new, highly efficient method for the conversion of alcohols to thiolesters and thiols”. Tetrahedron Letters. 22 (33): 3119—3122. DOI:10.1016/S0040-4039(01)81842-6..mw-parser-output cite.citation{font-style:inherit}.mw-parser-output q{quotes:"""""""'""'"}.mw-parser-output code.cs1-code{color:inherit;background:inherit;border:inherit;padding:inherit}.mw-parser-output .cs1-lock-free a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/6/65/Lock-green.svg/9px-Lock-green.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output .cs1-lock-limited a,.mw-parser-output .cs1-lock-registration a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/d/d6/Lock-gray-alt-2.svg/9px-Lock-gray-alt-2.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output .cs1-lock-subscription a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/a/aa/Lock-red-alt-2.svg/9px-Lock-red-alt-2.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registration{color:#555}.mw-parser-output .cs1-subscription span,.mw-parser-output .cs1-registration span{border-bottom:1px dotted;cursor:help}.mw-parser-output .cs1-hidden-error{display:none;font-size:100%}.mw-parser-output .cs1-visible-error{font-size:100%}.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registration,.mw-parser-output .cs1-format{font-size:95%}.mw-parser-output .cs1-kern-left,.mw-parser-output .cs1-kern-wl-left{padding-left:0.2em}.mw-parser-output .cs1-kern-right,.mw-parser-output .cs1-kern-wl-right{padding-right:0.2em}
↑ Bertleff, W.; Roeper, M.; Sava, X. Carbonylation // Ullmann's Encyclopedia of Industrial Chemistry. — Weinheim : Wiley-VCH, 2005. — DOI:10.1002/14356007.a05_217.pub2.
↑ Lehninger, A. L.; Nelson, D. L.; Cox, M. M. Principles of Biochemistry. — 3rd. — New York : Worth Publishing, 2000. — ISBN 1-57259-153-6.
↑ Mansuy, D.; Dansette, P. M. (2011). “Sulfenic acids as reactive intermediates in xenobiotic metabolism”. Archives of Biochemistry and Biophysics. 507 (1): 174—185. DOI:10.1016/j.abb.2010.09.015.
↑ Dansette, P. M.; Rosi, J.; Debernardi, J.; Bertho, G.; Mansuy, D. (2012). “Metabolic Activation of Prasugrel: Nature of the Two Competitive Pathways Resulting in the Opening of Its Thiophene Ring”. Chemical Research in Toxicology. 25 (5): 1058—1065. DOI:10.1021/tx3000279.
↑ Cremlyn, R. J. An Introduction to Organosulfur Chemistry. — Chichester : John Wiley and Sons, 1996. — ISBN 0-471-95512-4.
Это заготовка статьи по органической химии. Вы можете помочь проекту, дополнив её. |

